
L’hypothyroïdie, un diagnostic sous-estimé; Partie 2: Prise en charge globale et interconnectée
Introduction
Vous avez compris que la thyroïde est une glande interconnectée et qu’il est nécessaire de s’occuper en premier lieu des facteurs régulateurs tels que l’alimentation, l’intestin, le stress ou l’environnement. Cette prise en charge suffit souvent à améliorer la situation. Nous allons dans cet article faire un focus sur la thyroïdite d’Hashimoto avant d’évoquer d’autres causes de dysfonctionnement de la thyroïde. En effet, la cause la plus fréquente d’hypothyroïdie reste la thyroïdite d’Hashimoto touchant 10 % des femmes et cela mérite un approfondissement. Pour les autres atteintes de la thyroïde, vous constaterez que quel que soit le niveau du dysfonctionnement, on retrouve souvent les mêmes causes, à savoir ; l’altération du microbiote intestinal, le stress, l’inflammation chronique et les toxines de l’environnement.
La thyroïdite d’Hashimoto
La cause la plus fréquente d’inflammation envers la thyroïde est une maladie auto-immune avec production d’anticorps contre la thyroïde, il s’agit de la thyroïdite d’Hashimoto. Cette affection représente une des causes principales de diminution de la fonction thyroïdienne. Il s’agit d’un problème d’auto-immunité dont les causes pour la médecine classique restent mystérieuses, avec évocation d’une composante génétique, finalement sans retenir de causes précises. Dans la thyroïdite d’Hashimoto, la majorité des médecins ne prennent pas en charge le problème de l’auto-immunité. Pourtant le contrôle de l’auto-immunité est essentiel et il faut se rappeler que la thyroïdite d’Hashimoto, avant d’être une maladie de la thyroïde, est avant tout une maladie auto-immune et qui dit auto-immunité doit s’intéresser à l’intestin.
Le rôle de l’intestin et du gluten
De nombreuses recherches scientifiques pointent du doigt l’intestin comme vraisemblable origine de nombreuses maladies auto-immunes. On sait par exemple qu’une intolérance au gluten ou une sensibilité au gluten est fortement reliée statistiquement à la maladie d’Hashimoto (1,2). En effet, on sait que le gluten est le composé alimentaire qui provoque le plus fréquemment des altérations de la muqueuse intestinale (3) favorisant ainsi l’auto-immunité. De plus, il existe un lien entre la structure moléculaire du gluten et certains composants de la glande thyroïdienne, ce qui pourrait expliquer l’augmentation du risque d’auto-immunité. Dès lors, il est justifié dans la maladie d’Hashimoto, de rechercher une maladie cœliaque. D’autant plus, si l’on tient compte d’une étude italienne de 2014 qui a évalué le profil clinique des personnes souffrant de maladie cœliaque sur 14 ans et qui a montré que les formes extra-digestives étaient de plus en plus nombreuses (ostéoporose, infertilité, anémie, etc.) avec une large proportion des personnes présentant une maladie auto-immune, principalement la thyroïdite d’Hashimoto (2). Ces constats ont été retrouvés dans de nombreuses autres études (13,14).
En cas d’absence d’argument pour cette maladie, il faut évoquer une sensibilité au gluten. Les études montrent que même dans la sensibilité au gluten, il y a une grande proportion de personnes présentant une maladie auto-immune (12). Dans ce cas, une prédisposition génétique contre le gluten (HLA DQ2/8) et/ou la présence d’anticorps antigliadine pourraient confirmer cette suspicion. Toutefois, selon certains auteurs, l’exclusion devrait être systématique, car le gluten a un impact négatif sur la muqueuse intestinale favorisant le leakygut.
Dans les régimes d’exclusion, nous avons déjà vu que certains nutritionnistes proposent d’aller plus loin. Ainsi, le Dr Saignalet, dans son concept de l’alimentation ancestrale, propose l’exclusion du gluten, des produits laitiers et du maïs. D’autres auteurs, s’inspirant des concepts de l’alimentation paléolithique, excluent toutes les céréales, les produits laitiers, les légumineuses et même les solanacées. Les arguments ont été discutés dans la partie 2 de cet article.
D’autre part, il existe de nombreuses causes pouvant créer une augmentation de la perméabilité intestinale et ainsi déclencher ou entretenir une maladie auto-immune telle qu’une dysbiose intestinale, un SIBO, des infections digestives (candidose, parasites, yersinia, Epstein Barr, etc..). Nous comprenons donc pourquoi il est important de s’occuper de son intestin si l’on veut protéger la thyroïde contre les attaques des anticorps afin d’éviter ou de réduire la destruction progressive du tissu thyroïdien.
Le stress
Le stress est également un facteur déterminant dans la survenue de la thyroïdite d’Hashimoto (4, 5,6). La prise en charge a déjà été discutée dans la partie 2 de cet article.
L’importance de la vitamine D
La carence en vitamine D est souvent reliée à de nombreuses maladies auto-immunes incluant la thyroïdite d’Hashimoto. Les études médicales montrent une relation entre la maladie d’Hashimoto et la carence en vitamine D (7) ainsi que l’intérêt de la supplémentation en vitamine D dans cette maladie (17).
Les perturbations des hormones sexuelles et l’insulino-résistance
Les perturbations des hormones sexuelles (estrogènes, androgènes) sont également impliquées dans la survenue de maladies auto-immunes telle que la thyroïdite d’Hashimoto. Par exemple, le syndrome des ovaires polykystiques est connu pour être lié à une augmentation du risque de certaines maladies auto-immunes telles que la thyroïdite d’Hashimoto ou le lupus (9,10). Une étude médicale a montré que l’augmentation des estrogènes et du ratio estrogènes/progestérone était directement liée à l’augmentation des anticorps antithyroïdiens chez ces femmes (11). Pour information, le syndrome des ovaires polykystiques est caractérisé par un trouble hormonal qui touche presque 10 % des femmes comprenant une augmentation inhabituelle de la production d’androgènes dans les ovaires ce qui perturbe la production d’ovules. Le PCOS est souvent en relation avec la présence d’une insulinorésistance qui favorise au niveau de l’ovaire un excès d’androgènes. La prise en charge des problèmes de glycémie et de l’insulino-résistance est une stratégie incontournable dans la prise en charge de ces problèmes
Points clés de la prise en charge de la thyroïdite d’Hashimoto
- La première étape est de changer l’alimentation. Au début, il est recommandé d’éliminer les sucres raffinés et les sucres artificiels et d’éviter le gluten. Dans certains cas, il est utile d’aller plus loin en éliminant toutes les céréales (à part peut-être le quinoa). Il est également recommandé d’enlever également les produits laitiers, les légumineuses et les huiles industrielles riche en oméga 6 (huile, de mais, tournesol, carthame etc.).
- Parallèlement, il faut corriger les déficits nutritionnels spécifiques de la thyroïde (fer, sélénium, zinc, vitamine A,D, B12, magnésium), il est particulièrement important d’optimiser la vitamine D et le niveau de sélénium. La prise d’iode dans la maladie d’Hashimoto reste controversée, des prises d’iode importantes pourraient augmenter les réactions auto-immunes contre la thyroïde (15-17). Il est préférable, en cas de carence, de ne pas dépasser des doses nutritionnelles (150 à 300 microgrammes /j).
- En cas d’épuisement ou de stress chronique vérifier les taux de cortisol et traiter la faiblesse des surrénales avec des vitamines spécifiques et des herbes adaptogènes (exemple : ashwaganda et ginseng).
- Il peut être nécessaire de rechercher et traiter des infections digestives telles qu’une dysbiose intestinale, un SIBO (small intestinal overgrowth bacteria), une candidose, ou des parasites, etc..
- Il faut penser également à rechercher et traiter des infections chroniques à bas bruit (Epstein Barr, helicobacter pilori)
Après une période de deux à 3 mois, si les valeurs des hormones thyroïdiennes sont basses et/ou que les symptômes ne s’améliorent pas, il faut envisager une hormonothérapie de substitution :
- soit sous forme de T4 synthétique (lévothyroxine). Cette forme synthétique ne contient que de la T4. Il faut souvent attendre une dizaine de jours avant que la conversion de la T4 en T3 active se fasse. Mais si vous avez des difficultés à convertir T4 en T3 soit vous devez augmenter les doses de levothyroxine soit prendre des d’extraits secs de thyroïde d’origine. Certaines marques contiennent du lactose, des protéines de lait qui peuvent être mal tolérées chez ceux très sensibles. La Tirosint, par exemple, ne contient pas de lactose, de gluten, de colorants ou de maïs
- soit sous forme d’extraits secs de thyroïde d’origine animale. C’est une forme naturelle d’hormone thyroïdienne provenant de glande de porc. Ces préparations contiennent de la T4 et de la T3, l’effet est plus rapide, en quelques jours, du fait de la forme active T3. Cette préparation est particulièrement efficace lorsque la conversion T4 à T3 est peu efficace. Certaines personnes peuvent réagir trop fort avec des signes d’anxiété, palpitations ou insomnies. Dans ce cas, il faut réduire la dose ou changer de forme. Les noms les plus connus sont Armour, Nature-Throid, Westhroid, WP Thyroid.
B) Tenir compte d’autres origines de l’hypothyroïdie
Il est important de se rappeler que la physiopathologie de ce système hormonal débute dans le cerveau (hypothalamus et hypophyse), région qui active la glande thyroïdienne. Les hormones sont par la suite transportées par des protéines du sang jusqu’au lieu ou elles doivent agir, puis l’hormone T4 doit être convertie dans les tissus concernés (muscles, foie, cerveau, etc.) dans sa forme active avant d’activer les gènes de la cellule qui va réguler le métabolisme. Des dysfonctionnements peuvent survenir à tous ces niveaux. Dès lors, il faut se méfier de l’appréciation réductrice de nombreux médecins, qui se contentent du dosage de la TSH comme dépistage de l’hypothyroïdie. Nous savons maintenant que l’évaluation d’une hypothyroïdie est plus complexe que cela et que même des valeurs normales de la TSH ou de l’hormone T4 ne permettent pas toujours d’exclure ce diagnostic. Nous allons voir quelques situations classiques qui peuvent conclure de façon erronée à un mauvais diagnostic. Dans la plupart des cas, vous constaterez que les facteurs incriminés qui affectent la thyroïde sont toujours les mêmes, à savoir : l’alimentation, l’intestin, le stress, les infections ou inflammations chroniques et les toxines de l’environnement.
L’hypothyroïdie d’origine cérébrale due à une dysfonction de l’hypothalamus ou de l’hypophyse
Dans ce cas, on peut constater une TSH plutôt basse avec une T4 basse associée à des signes d’hypothyroïdie, les causes peuvent être diverses. Du point de vue médical, il faut évoquer un adénome hypophysaire, principalement un prolactinome. En absence d’une pathologie organique, il faut penser avant tout au stress. En effet, l’excès de cortisol provenant des surrénales peut à la longue affecter l’hypophyse qui réduit sa sécrétion de TSH avec comme conséquence une baisse de l’activité de la glande thyroide.
L’autre cause fréquente est l’inflammation chronique, dans ce cas l’hypothalamus peut être perturbé par un milieu inflammatoire du aux cytokines inflammatoires circulantes. L’origine de l’inflammation chronique peut être du à diverses cause telles que des maladies virales chroniques, un leakygut ou une dysbiose intestinale, etc. La prise en charge consiste souvent à traiter la cause de l’inflammation. Dans les maladies virales, il faut soutenir une bonne immunité TH1, alors que pour l’intestin, c’est la prise en charge de la muqueuse intestinale ou l’arrêt des aliments mal tolérés qui peut aider.
L’hypothyroïdie due à une mauvaise conversion de l’hormone T4 en T3 par diminution de l’activité de la 5 déiodinase
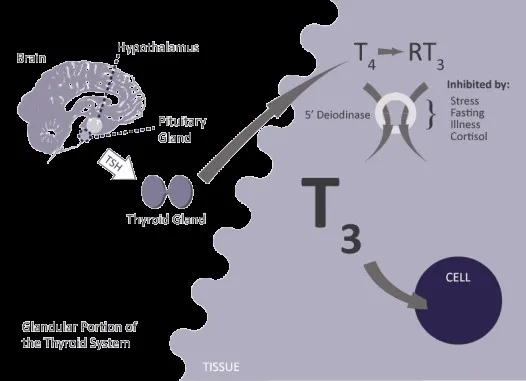
Dans ce cas de figure, on peut avoir une TSH et une T4 dans la norme avec une T3 basse associées à des signes cliniques et des symptômes d’hypothyroïdie. De nombreux facteurs peuvent perturber la fonction de l’enzyme 5 déiodinase, voici peut-être les causes principales :
Une déficience des cofacteurs :
Rappelez-vous que cette conversion nécessite divers cofacteurs comme le sélénium, le zinc, la vitamine A, C, certaines vitamines B, principalement la B12 (18), etc. La correction des déficits nutritionnels permet d’améliorer la conversion T4 en T3. Probablement l’action de ces micronutriments provient de leur capacité à réduire le stress oxydatif et l’inflammation qui joue un rôle majeur dans cette dysfonction de la conversion T4 en T3 active (19). Ainsi diverses études ont montré l’intérêt de complexes antioxydants dans cette prise en charge (20,21).
Une inflammation chronique :
Une des causes fréquentes d’inflammation chronique provient de la dysbiose intestinale favorisant le largage de lipopolysaccharides bactériens dans le sang. Il faut également penser dans ce cas à une intolérance au gluten qui reste l’intolérance alimentaire la plus impliquée dans le leakygut. D’autres sources d’inflammations chroniques (effets des cytokines) telles que des maladies virales chroniques (par exemple : Epstein Barr) ou la maladie de Lyme peuvent limiter l’enzyme 5 déiodinase. Dans ce cas, la prise en charge va dépendre de la prise en charge de la cause de l’inflammation.
Un stress chronique :
L’excès de cortisol réduit la conversion des hormones thyroïdiennes de la forme inactive (T4) en forme active T3. C’est ainsi que le stress chronique est néfaste pour la thyroïde et lorsque la thyroïde ne fonctionne pas bien, il est nécessaire de contrôler son stress. C’est pourquoi en cas de faiblesse de la thyroïde, avant toute chose, il est préférable de réduire le stress et de calmer l’axe HPA avant de donner des hormones thyroïdiennes au risque d’avoir des effets secondaires désagréables.
L’hypothyroïdie par augmentation de la TBG, attention à l’excès d’œstrogènes
Dans ce cas, on peut constater une TSH normale avec des hormones T3, T4 plutôt basses. La TBG (thyroid binding globulin) est une des trois protéines transporteuses des hormones thyroïdiennes dans le sang. L’augmentation dans le sang de la TBG va augmenter la liaison des hormones thyroïdiennes à ces protéines avec diminution de la fraction libre. La cause la plus fréquente est due à un excès d’estrogènes, particulièrement lors d’une hormonothérapie substitutive (contraceptifs). On sait que la substitution oestrogénique peut avoir des effets positifs lors de la ménopause (bouffées de chaleur), mais peut également affecter la thyroïde, car un excès d’estrogènes peut inhiber la conversion T4 en T3 et réduire la disponibilité de la fraction libre des hormones thyroïdiennes. Un excès d’œstrogènes peut être également favorisé par des polluants de l’environnement de type perturbateurs endocriniens (PCB (11), phthalates, bisphenol A). Manger des crucifères et des fibres aide à éliminer l’excès d’estrogènes. Il est également conseillé de favoriser une alimentation bio, sans pesticides et éviter les xénoestrogènes de synthèse (PCB, phthalates, bisphenol A). Le Di indolymethane (DIM) qui est un extrait naturel de brocoli ainsi que le calcium d-glucarate aident à éliminer l’excès d’oestrogènes. On peut également améliorer la sécrétion biliaire (gingembre, taurine, pissenlit, etc..) et améliorer la méthylation par un bon niveau de vitamine B12.
Dr. A. D’oro
Références :
- Sharma BR « Celiacautoimmunity in autoimmunethyroiddiseaseishighlyprevalentwith a questionable impact » Indian J EndocrinolMetab 2016 Jan-Feb ;20(1) :97-100
- Volta U « The changingclinical profil of celiacdisease : a 15-year experience in an italianreferral center » BMC Gastroenterol 2014 Nov 18 ;14 :194
- Hollon J « Effects of gliadin on permeability of intestinal biopsy explants fromceliacdisease patients and patients with non celiac gluten sensitivity » Nutrients 2015 Feb 27 ;7(3) :1565-76
- Mizokami T « Stress and thyroidautoimmunity » Thyroid 2004 Dec ;14(12) :1047-55
- Tsatsoulis A « The role of stress in the clinical expression of thyroidautoimmunity » Ann N Y AcadSci. 2006 Nov ;1088 :382-95
- Damian L « No definitiveevidence for a connectionbetweenautoimmunethyroiddiseases and stress in women » Neuro EndocrinolLett. 2016 Jul 16 ;37(3) :155-162
- Mazokopakis EE « Is vitamin D related to pathogenesis and treatement of Hashimoto’sthyroiditis ? » Hell J Nucl Med 2015 Sep-Dec 18(3) :227-7
- Arslan MS « Isolatedvitamin D deficiencyis not associatedwithnonthyroidalillness syndrome, but withautoimmunity » ScientificWorldJournal 2015 :239815
- Mobeen H « PolycysticOvary Syndrome May Be an AutoimmuneDisorder » Scientifica 2016 :4071735
- Arduc « High prevalence of Hashimoto’sthyroiditis in patients withpolycysticovary syndrome :does the imbalancebetweenostradiol and progesterone play a role » EndocrRes. 2015 ;40(4) :204-10
- Soechitram SD « Polyclorinatedbiphenylexposure and deiodinaseactivity in young infants » Sci Total Environ 2017 Jan 1 ;574 :1117-1124
- Carrocio « High proportions of people withnonceliacwheatsensitivity have autoimmunedisease of antinuclearantibodies » Gastroenterology 2015 Sep ;149(3) :596-603
- Pinto-Sanchez « Extraintestinal manifestations of coeliacdisease » Dig Dis 2015 ;33(2) :147-54
- Battacharya M « Celiacdiseasepresentation in a tertaryreferral in India :current scenario » Indian J Gastroenterol 2013 Mar(2) :98-102.
- Shan Z « Iodinestatus and prevalence of thyroiddisordersafter introduction of mandatoryuniversalsaltiodization for 16 years in china : a cross-sectionalstudyin 10 cities » Thyroid 2016 Aug ;26 :1125-30
- Bliddal S « Thyroidfunction and autoimmunity in Danishpregnantwomenafter an iodine fortification program and associations withobstetricoutcomes » Eur J Endocrinol 2015 Dec ;173(6) :709-18
- Balercia G « Vitamin D and Thyroiddisease : to D or not to D ? » Eur J Clin Nutr. 2015 Mar ;69(3) :291-6
- Collins AB « Prevalence of vitamine B12 deficiencyamong patients withthyroid dysfonction » Asia Pac J Clin Nutr. 2016 ;25(2) :221-6
- Mancini A « ThyroidHormones , Oxydative stress and inflammation » MediatorsInflamm 2016 : 6757154
- Chenk K « Type 1 5-deiodinase activityisihnibited by oxydative stress and restored by alpha-lipoicacid in HepG2 cells » BiochemBiophyRes Commun 2016Apr 8 ;472 :496-501
- Moncayo R « Proof of concept of the WOMED model of benignthyroiddisease : Restitution of thyroidmorphologyafter correction of physical and psychologicalstressors and magnesiumsupplementation » BBA Clin 2014 Dec 31 ;3 :113-22